Riociguat representa el primer miembro de una nueva clase de compuestos estimuladores de la guanilato ciclasa soluble.
En la actualidad el tratamiento con riociguat está aprobado por la FDA en la hipertensión arterial pulmonar para mejorar la capacidad de ejercicio, mejorar la clase funcional de la OMS y retrasar en el tiempo el deterioro clínico; y en hipertensión pulmonar tromboembólica crónica inoperable o persistente/recurrente después de la intervención quirúrgica, con el objetivo de mejorar la capacidad de ejercicio y la clase funcional de la OMS. El riociguat es el primer fármaco que ha mostrado beneficios clínicos en la hipertensión pulmonar tromboembólica crónica, una entidad para la cual no existe ningún tratamiento farmacológico específico autorizado.
Mecanismo de acción
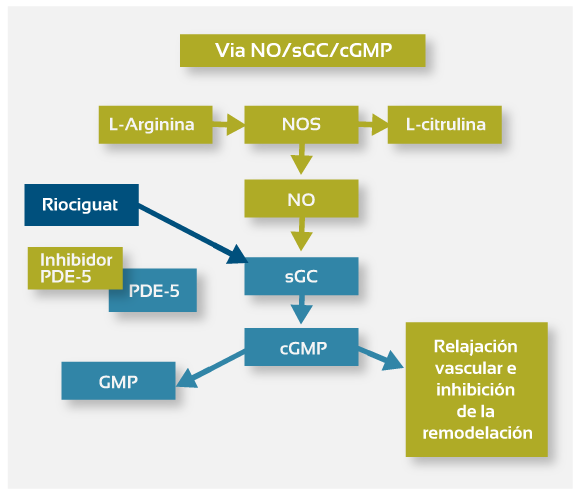
La hipertensión arterial pulmonar (HAP) se asocia a una disfunción del endotelio vascular pulmonar y deficiencia de la síntesis de óxido nítrico (NO). En la HAP se observa una disminución de la biodisponibilidad del NO; esta alteración se relaciona con un aumento de la dimetilarginina asimétrica inhibidora de NO sintetasa endógena, y una disminución progresiva de la expresión endotelial de esta enzima. Ante esta deficiencia de NO ocurre una estimulación insuficiente de la guanilato ciclasa soluble (sGC). La sGC es un componente clave de la vía de señalización del NO. La unión del NO a la sGC cataliza la síntesis del segundo mensajero guanosin monofosfato cíclico (cGMP). El cGMP produce relajación vascular, inhibe la proliferación del músculo liso vascular, el reclutamiento de leucocitos y la agregación plaquetaria (1; 2).
A partir de estos conocimientos se ha iniciado una línea de investigación que ha dado como resultado el desarrollo de los estimuladores de la sGC, compuestos que sensibilizan a la enzima aún a bajos niveles de NO manteniéndola en su configuración activa. Estos agentes también pueden aumentar la actividad de la sGC en forma directa (2). Riociguat representa el primer miembro de esta nueva clase de compuestos estimuladores de la guanilato ciclasa soluble.
El riociguat restaura la vía NO-sGC-cGMP mediante un mecanismo de acción dual: sensibiliza la sGC al NO endógeno estabilizando la unión del NO al grupo prostético hemo de la enzima; y estimula de forma directa la sGC imitando la acción del NO, pero a través de un sitio de unión diferente e independiente (Figura 1). Experiencias in vitro demuestran que el riociguat aumenta la actividad de la sGC hasta 73 veces y, actúa en sinergia con el NO incrementándola hasta 122 veces (1; 2).
La habilidad de riociguat para estimular directamente la sGC sin depender del NO establece una diferencia fundamental con otros fármacos cuya acción se basa en la presencia del NO. Por ejemplo, los inhibidores de la PDE-5 evitan la degradación del cGMP; por ende su acción está supeditada a la existencia del segundo mensajero (1; 2). El buen perfil de seguridad de riociguat se atribuye a que sus beneficios son mediados por la vía del NO-sGC-cGMP en tanto los efectos adversos son independientes de esta vía.
Aumentando el cGMP el riociguat inhibe la vasoconstricción y la inflamación, y previene la trombosis. De hecho, estudios preclínicos en modelos animales de HAP evidenciaron que el riociguat tiene efectos positivos sobre la hemodinamia pulmonar, la hipertrofia del ventrículo derecho y el remodelamiento de los vasos pulmonares (1; 3).
Figura 1: Mecanismo de acción de riociguat (Modificada de 1)
Experiencia clínica
Entre 2008 y 2010 se realizaron estudios de fase I y II en pacientes con hipertensión pulmonar tromboembólica crónica (HPTEC) y con HAP en los cuales se constataron una buena tolerancia y un perfil de seguridad favorable de riociguat (tres dosis diarias de 1.0 a 2.5 mg) y su impacto positivo en la capacidad de ejercicio, la clase funcional, los síntomas, y los parámetros de hemodinamia pulmonar (3, 4, 5, 6, 7, 8)
La evidencia sobre la cual se sustenta la aprobación del uso de riociguat proviene de los ensayos clínicos en CHEST-1 en pacientes con hipertensión pulmonar tromboembólica crónica y PATENT-1 en pacientes con hipertensión arterial pulmonar. En el diseño de ambos estudios internacionales y multicéntricos, Fase III, se contempló la asignación aleatorizada en modo doble ciego a riociguat o placebo. El CHEST-1 y el PATENT-1 demostraron una mejoría estadísticamente significativa de la capacidad de ejercicio medido por la prueba de la distancia caminada en seis minutos (6MWD por su sigla en inglés). La elección de esta prueba como el criterio primario de valoración se basa en su poder de predicción, independiente, de mortalidad y su correlación con los cambios en el estado funcional y la sobrevida. También se observaron diferencias significativas a favor de riociguat en los criterios de valoración secundarios incluyendo la resistencia vascular pulmonar, niveles de NT-proBNP y clase funcional de la OMS. La tolerancia se calificó como buena con una incidencia de efectos adversos comparable a la del placebo (9, 10)
CHEST-1
En el ensayo clínico CHEST-1 (Chronic Thromboembolic Pulmonary Hypertension Soluble Guanylate Cyclase–Stimulator Trial 1) se incluyeron 261 pacientes con hipertensión pulmonar tromboembólica crónica, técnicamente inoperables o con enfermedad persistente o recurrente después de la endarterectomía pulmonar (10). Ninguno de ellos había recibido tratamiento específico (antagonistas del receptor de endotelina, análogos de prostaciclinas, inhibidores PDE-5 ni donantes de NO) durante los tres meses previos al estudio. Se asignaron a riociguat por vía oral 173 pacientes, en un esquema individual de titulación de dosis con ajustes cada 2 semanas en función de la presión arterial sistémica y los síntomas de hipotensión (1; 1.5; 2 o 2.5 mg tres veces al día) por un periodo de 8 semanas. Los otros 88 recibieron placebo. Se estableció como criterio primario de valoración el cambio, versus el valor basal, de la 6MWD en la semana 16º. Los pacientes que recibieron riociguat mostraron una mejoría de la 6MWD estadísticamente significativa respecto del valor basal (+39 metros riociguat vs. -6 metros placebo; diferencia 46 metros; p< 0.001). La eficacia significativa de riociguat se manifestó también en los criterios de valoración secundarios, clínicos y hemodinámicos (Tabla 1). El tiempo transcurrido hasta el agravamiento de la enfermedad no difirió significativamente entre los grupos de tratamiento. Los efectos adversos graves atribuidos al riociguat fueron síncope, gastritis, insuficiencia renal aguda (un caso fatal) e hipotensión. La tasa de suspensión del tratamiento por efectos adversos graves fue del 2% en cada grupo, ninguno de ellos relacionado con el tratamiento (Tabla 2) (10)
Figura 1: Mecanismo de acción de riociguat (Modificada de 1)
|
|
Riociguat |
Placebo |
p |
|
6MWD |
+39 metros |
-6 metros |
< 0.001 |
|
NT-proBNP |
–291 |
76 |
< 0.001 |
|
Clase funcional OMS
|
|||
|
Mejoría |
57 (33%) |
13 (15%) |
= 0.003 |
|
Estabilización |
107 (62%) |
68 (78%) |
|
|
Peoría |
9 (5%) |
6 (7%) |
|
|
Hemodinamia pulmonar
|
|||
|
Presión de la arteria pulmonar (mm Hg) |
–4 |
0.8 |
< 0.001 |
|
Resistencia vascular pulmonar |
-226 dyn-sec-cm-5 |
+23 dyn-sec-cm-5 |
< 0.001 |
|
Presión arterial media (mm Hg) |
–9 |
–0.3 |
< 0.001 |
|
Gasto cardiaco (litros/min) |
0.8 |
–0.03 |
< 0.001 |
Tabla 2: CHEST-1 perfil de seguridad
|
|
Riociguat |
Placebo
|
|
Insuficiencia ventricular derecha |
3% |
3% |
|
Síncope |
2% |
3% |
|
Hemoptisis |
2% |
- |
|
Discontinuación por efectos adversos |
3% |
2% |
CHEST-2
El estudio CHEST-2 es una fase de extensión del anterior, abierta, integrada por 237 pacientes. La investigación contó con un primer período, modo ciego, en el cual todos los participantes se asignaron a riociguat con un esquema de titulación de dosis hasta alcanzar el efecto óptimo o un máximo de tres dosis diarias de 2.5mg. Este estudio demuestra la seguridad y eficacia clínica a largo plazo de riociguat. Un análisis preliminar de los datos de 194 individuos, en la semana 12º, mostró la continuidad de la ganancia de metros en la prueba de 6MWD en los tratados con riociguat versus placebo. Los pacientes tratados con riociguat en el CHEST-1 aumentaron la distancia caminada a 63 metros y los que previamente habían recibido placebo 35 metros, respecto de los valores iniciales del CHEST-1. También mejoró la clase funcional de OMS. La evaluación al año confirmó el beneficio sostenido de riociguat (Tabla 3) (10, 11). La tolerancia y seguridad a largo plazo fueron buenas; el 89% de los pacientes informó efectos adversos (Tabla 4). Al año el 97% de los pacientes aun sobrevivía y el 87% no había experimentado peoría clínica (10, 11).
Tabla 3: CHEST-2 eficacia de riociguat a largo plazo
|
|
Tratamiento en el CHEST-1
|
|
|
|
Riociguat |
Placebo
|
|
6MWD |
||
|
12 semanas |
63 metros |
35 metros |
|
12 meses (*) |
48 metros |
|
|
Mejoría clase funcional OMS (%) |
||
|
12 semanas |
41% |
38% |
|
Clase funcional OMS (%) 12 meses |
||
|
Mejoría |
51% |
|
|
Estabilización |
47% |
|
|
Peoria |
2% |
|
(*) Al cabo de 12 meses de tratamiento con riociguat todos los participantes alcanzaron una mejoría similar de la 6MWD, independientemente del tratamiento recibido en el CHEST-1.
Tabla 4: CHEST-2 perfil de seguridad
|
Mareos |
8% |
|
Dispepsia |
7% |
|
Hipotensión |
6% |
|
Efectos adversos graves |
30% |
|
Efectos adversos graves relacionados con el fármaco |
4% |
PATENT-1
El ensayo clínico PATENT-1 (Pulmonary Arterial Hypertension Soluble Guanylate Cyclase–Stimulator Trial 1) incluyó 443 individuos con hipertensión arterial pulmonar, sin tratar o tratados con antagonistas del receptor de la endotelina o prostanoides no intravenosos (9). Los participantes se asignaron al azar, en proporción 4:2:1, a dos esquema de tres dosis diarias de riociguat por vía oral por un periodo de titulación individual de dosis de 8 semanas (1.0 hasta 2.5 mg, n= 254; 1.0 hasta 1.5 mg, n=63) o placebo (n= 126). Se estableció como criterio primario de valoración el cambio, versus el basal, en la 6MWD en la semana 12º. También se analizó el tiempo hasta el deterioro clínico, definido como la combinación de mortalidad, trasplante cardio/pulmonar, septostomía atrial, internación por agravamiento persistente de la HAP, iniciación de un nuevo tratamiento específico para HAP, deterioro persistente de los resultados de la 6MWD o la clase funcional de la OMS.
En el grupo de pacientes tratados con riociguat se evidenció una mejoría estadísticamente significativa de la 6MWD respecto del valor inicial en comparación con placebo (promedio +30 metros riociguat 2.5 mg vs. -6 metros placebo; diferencia 36 metros; p< 0.001). El tratamiento con riociguat se asoció con cambios positivos significativos también en los criterios de valoración secundarios (Tabla 5). El otro resultado relevante fue la prolongación significativa del intervalo de tiempo transcurrido hasta el deterioro clínico en los pacientes tratados con riociguat versus placebo (p= 0.0046), con una incidencia significativamente más baja de eventos clínicos en la semana 12 (1.2% vs. 6.3% placebo; p= 0.02) (Tabla 5). El beneficio se mantuvo constante independientemente de otros tratamientos. Los autores concluyen del análisis de subgrupos que existe una mayor probabilidad de que el beneficio de riociguat resulte clínicamente más relevante en los pacientes con clase funcional OMS III y IV en comparación con las I y II. Asimismo hacen notar que, si bien no se han realizado estudios comparativos, cabeza a cabeza, el tamaño del efecto de riociguat en la prueba de 6MWD resultó comparable a los de los otros tratamientos farmacológicos específicos para la HAP. La evaluación del grupo con dosis máxima de 1,5 mg tres veces al día tuvo fines meramente exploratorios y sus resultados no se vuelcan en esta descripción. En el grupo tratado con riociguat las discontinuaciones relacionadas con efectos adversos graves se debieron a elevación de las enzimas hepáticas, insuficiencia renal aguda y síncope. En el grupo placebo la suspensión del tratamiento por efectos adversos graves se relacionó con sincope, hipoxemia y peoría de la HAP. Los casos de mortalidad no se asociaron con el tratamiento (Tabla 6) (9).
Tabla 5: PATENT-1 Riociguat en hipertensión arterial pulmonar
|
|
Riociguat 2,5 mg tres veces al día |
Placebo |
p |
|
6MWD |
+36 metros |
-6 metros |
< 0.001 |
|
NT-proBNP picog/ml
|
–198 |
232 |
< 0.001 |
|
Score de disnea de Borg |
–0.4 |
0.1 |
= 0.002 |
|
Incidencia de eventos de deterioro clínico |
1.2% |
6.3% |
= 0.02 |
|
Clase funcional OMS |
|||
|
Mejoría |
53 (21%) |
18 (14%) |
= 0.003 |
|
Estabilización |
192 (76%) |
89 (71%) |
|
|
Peoria |
9 (4%) |
18 (14%) |
|
|
Hemodinamia |
|||
|
Resistencia vascular pulmonar |
-223 dyn · sec · cm–5 |
-9 dyn · sec · cm–5 |
< 0.001 |
|
Presión de la arteria pulmonar (mm Hg) |
–4 |
–0.5 |
< 0.001 |
|
Presión arterial media (mm Hg) |
–9 |
–1 |
< 0.001 |
|
Gasto cardiaco (litros/min) |
1 |
–0.01 |
< 0.001 |
|
Saturación venosa mixta de O2 (%) |
3 |
–2 |
< 0.001 |
Tabla 6: PATENT-1 perfil de seguridad
|
|
Riociguat 2,5 mg |
Placebo |
|
Síncope |
1% |
4% |
|
Peoría de la HAP |
< 1% |
2% |
|
Precordialgia |
1% |
1% |
|
Insuficiencia ventricular derecha |
1% |
1% |
|
Discontinuación por efectos adversos |
3% |
7% |
PATENT-2
El ensayo clínico PATENT-2 se diseñó como una fase de extensión del PATENT-1, a largo plazo, abierta, incluyó 396 pacientes. En las 8 semanas iniciales, con modo ciego, se titularon las dosis hasta obtener el efecto óptimo o el máximo de 2.5 mg tres veces al día, en todos los participantes. Los criterios primarios de valoración fueron seguridad y tolerancia. Analizados los datos de 363 participantes, el perfil de seguridad se calificó como bueno con una tasa de discontinuación por efectos adversos del 7.2% (Tabla 7). Al cabo del periodo de titulación se observó una mejoría de la prueba 6MWD (+51m y +49 en los tratados previamente con riociguat hasta un máximo de 2.5 o 1.5 mg, respectivamente) y también en los que habían recibido placebo (+42 m) respecto de la distancia caminada al inicio del PATENT-1. Una nueva evaluación de 214 pacientes, a los 12 meses, mostró una mejoría de +48 metros asociada al tratamiento con riociguat (Tabla 8). El 13% de los pacientes (n= 47) requirió el agregado de otra medicación para tratar la HAP, 46/47 por agravamiento de su condición (12; 9).
Tabla 7: PATENT-2, perfil de seguridad
|
Efectos adversos |
26 (7.2%) |
|
Mortalidad |
14 (3.9) |
|
Ausencia de eficacia |
3 (0.8) |
|
Ausencia de adherencia |
2 (0.6) |
|
Discontinuación voluntaria |
7 (1.9) |
Tabla 8: PATENT-2, eficacia de riociguat a largo plazo
|
|
Tratamiento en el PATENT-1 |
||
|
|
Riociguat 2.5 mg |
Riociguat 1.5 |
Placebo |
|
6MWD |
|||
|
8º semana |
+51 metros |
+49 metros |
+42 metros |
|
12 meses (*) |
+48 metros |
||
|
Clase funcional 12º semana (%) |
|||
|
Mejoría |
21 |
25 |
17 |
|
Estable |
77 |
69 |
75 |
|
Peoría |
2 |
6 |
7 |
|
Clase funcional 12 meses (%) |
|||
|
Mejoría |
36 |
||
|
Estable |
57 |
||
|
Peoría |
7 |
||
|
Clase funcional I/II (%) |
|||
|
Ingreso |
43 |
38 |
49 |
|
12º semana |
61 |
57 |
58 |
|
12 meses (*) |
68 |
||
(*) Al cabo de 12 meses de tratamiento con riociguat todos los participantes alcanzaron una mejoría similar de la 6MWD, independientemente del tratamiento recibido en el PATENT-1
El futuro
La HAP secundaria a disfunción sistólica ventricular izquierda, que está asociada a una elevada tasa morbimortalidad, tampoco tiene un tratamiento específico aprobado. En este contexto se ha llevado a cabo el estudio LEPHT (Left Ventricular Systolic Dysfunction Associated WithPulmonary Hypertension Riociguat Trial), aleatorizado, doble ciego, fase IIb. Participaron 201 pacientes con insuficiencia cardiaca causada por HAP secundaria a disfunción sistólica ventricular izquierda. Los participantes se asignaron a riociguat (tres dosis diarias de 0.5; 1 o 2 mg) por 16 semanas o placebo. Se estableció como criterio primario de valoración el cambio, corregido por placebo, de la presión media de la arteria pulmonar (mPAP) en la semana 16º. En el grupo tratado con tres dosis diarias de 2 mg de riociguat la mPAP disminuyó 6.1 mmHg versus la inicial (p< 0.0001), no obstante esta diferencia no resultó significativa respecto del placebo. En cambio, otros parámetros mejoraron significativamente en el grupo riociguat versus placebo, aumentaron el índice cardiaco (0.4 Lキmin−1キm−2; p= 0.0001) y el índice de volumen de eyección (5.2 mlキm−2; p= 0.0018) sin que se observaran cambios en la frecuencia cardiaca ni la presión sistólica sistémica. En base a este resultado, los autores consideran que la mejoría no se relaciona con una activación del reflejo simpático atribuible a una disminución de la presión sistólica (13). También disminuyeron significativamente la resistencia vascular pulmonar (−46.6 dynesキs−1キcm−5; p= 0.03) y sistémica (−239.3 dynesキs−1キcm−5; p= 0.0002); aunque no se observaron cambios ecocardiográficos ni en el nivel de NT-proBNP. Asimismo se registró una mejoría de la calidad de vida asociada al tratamiento con riociguat reflejada en una disminución de la puntuación del Minnesota Living With Heart Failure Score (p= 0.0002). La tolerancia se calificó como buena con una tasa de suspensión del tratamiento comparable en ambos grupos (13).
Características farmacológicas
Administrado por vía oral riociguat se absorbe rápidamente, con una biodisponibilidad del 94%, alcanzando el pico de concentración plasmática en 1.5 horas. Circula unido a proteínas en un 95%. Se metaboliza por la el sistema CYP (CYP1A1, CYP3A, CYP2C8, CYP2J2) y actúa como sustrato de las proteínas trasportadoras P-gp y BCRP. El metabolito activo M1 es catalizado por la CYP1A1, inducible por hidrocarbonos aromáticos policíclicos como los que encuentran en el humo del cigarrillo. La potencia de su metabolito activo oscila entre el 10 y 33%. En pacientes con HAP el riociguat tiene una vida media de 12 horas con una tasa de depuración de 1.8 litros /hora. El 40% se elimina por orina y el 53% por heces. La respuesta hemodinámica a riociguat se correlaciona con la concentración plasmática (1).
Indicaciones
- Hipertensión arterial pulmonar: para mejorar la capacidad de hacer ejercicio, mejorar la clase funcional de la OMS y retrasar en el tiempo el deterioro clínico.
- Hipertensión pulmonar tromboembólica crónica inoperable o persistente/recurrente después de la intervención quirúrgica: para mejorar la capacidad de realizar ejercicio y la clase funcional de la OMS.
Posología y dosis
Riociguat se administra por vía oral. Los alimentos no afectan la biodisponibilidad. Los antiácidos disminuyen su absorción por lo que se recomienda un intervalo de una hora entre ambos medicamentos.
Dosis inicial:
1 mg VO tres veces al día.
Se puede iniciar con una dosis inferior de 0.5 mg tres veces al día para disminuir el riesgo de hipotensión cuando se coadministra con inhibidores potentes del sistema CYP o las P-gp/BCRP (inhibidores de la proteasas del VIH, antimicóticos azoles) que aumentan la exposición sistémica a riociguat; y en pacientes con hipotensión, hipovolemia o disfunción autonómica.
Titulación
Aumentar 0.5 mg cada dos semanas, únicamente si la presión sistólica es > 95 mmHg y no hay síntomas de hipotensión.
Máximo 2.5 mg tres veces al día
En caso de hipotensión disminuir a 0.5 mg tres veces al día
Se puede considerar sobrepasar la dosis máxima de tres tomas diarias de 2.5 mg en pacientes que fuman
Adherencia
En caso de omisión de una dosis: continuar con la siguiente
Si se omiten más de tres dosis: reiniciar el esquema de tratamiento
Precauciones
No se han demostrado la seguridad y eficacia en pacientes con depuración de creatinina <15ml/min o diálisis o insuficiencia hepática (Child Pugh C)
Se debe evitar el uso de riociguat en pacientes con enfermedad venooclusiva pulmonar o discontinuarlo en caso de edema pulmonar.
Contraindicaciones
Riociguat está contraindicado en embarazadas. Se recomienda descartar el embarazo previamente a iniciar el tratamiento, usar métodos anticonceptivos (métodos de barrera u hormonales o ambos) durante el tratamiento y hasta un mes después de su discontinuación. El uso de riociguat en mujeres está restringido al programa “Adempas®, evaluación de riesgo y estrategia de mitigación” (REMS Program)
Está contraindicado el uso concomitante con nitratos y donantes de NO; inhibidores de la PDE específicos o inespecíficos.
Legislación vigente
La FDA ha clasificado a riociguat como medicamento huérfano y aprobado su indicación para el tratamiento de la hipertensión pulmonar tromboembólica crónica inoperable o persistente/recurrente después de la intervención quirúrgica, con el objetivo de mejorar la capacidad de ejercicio y la clase funcional de la OMS, y la hipertensión arterial pulmonar para mejorar la capacidad de ejercicio, mejorar la clase funcional de la OMS y retrasar en el tiempo el deterioro clínico.
En septiembre de 2013, riociguat fue aprobado en Canadá para el tratamiento de la hipertensión pulmonar tromboembólica crónica (HPTEC) inoperable o persistente/recurrente después de la intervención en pacientes adultos en clase funcional II o III de la OMS.
En febrero 2013 se presentó una solicitud de registro ante la Agencia Europea de Medicamentos que aún está pendiente de aprobación.
En Argentina se presentó ante la ANMAT y se aguardan los resultados de la evaluación para su aprobación.
 Bibliografía
Bibliografía
1- Kim N.H.. Riociguat: an upcoming therapy in chronic thromboembolic pulmonary hypertension?. Eur Respir Rev., 2010; 19: 115, 68–71
2- Stasch JP, et al. Soluble guanylate cyclase as an emerging therapeutic target in cardiopulmonary disease. Circulation 2011;123:2263–73
3- Ghofrani HA, Hoeper MM, Halank M, et al. Riociguat for chronic thromboembolic pulmonary hypertension and pulmonary arterial hypertension:
first long-term extension data from a phase II study [abstract]. Am J Respir Crit Care Med. 2010;181:A6770.
4- Ghofrani HA., Hoeper MM, Halank M, et al. Riociguat for chronic thromboembolic pulmonary hypertension and pulmonary arterial hypertension: a phase II study. Eur Respir J., 2010; 36: 792–799
5- Frey R, Muck W, Unger S, et al. Single-dose pharmacokinetics, tolerability and safety of the soluble guanylate cyclase stimulator BAY 63–2521; an ascending-dose study in healthy male volunteers. J Clin Pharmacol. 2008;48:926 –934.
6- Frey R, Muck W, Kirschbaum N, et al. G. Riociguat (BAY 63–2521) and warfarin: a pharmacodynamic and pharmacokinetic interaction study [published online ahead of print August 27, 2010]. J Clin Pharmacol. doi: 10.1177/0091270010378119.
7- Hoeper MM, Halank M, Wilkens H, et al. Riociguat for patients with pulmonary hypertension associated with interstitial lung disease [abstract]. Am J Respir Crit Care Med. 2010;181:A5262.
8- Grimminger, F et al. First acute haemodynamic study of soluble guanylate cyclase stimulator riociguat in pulmonary hypertension. Eur Respir J 2009;33:785–792
9- Ghofrani HA, Galiè N, Grimminger F., et al. Riociguat for the Treatment of Pulmonary Arterial Hypertension. N Engl J Med., 2013;369:330-40. (PATENT)
10- Ghofrani HA, D’Armini AM, Grimminger F., et al. Riociguat for the Treatment of Chronic Thromboembolic Pulmonary Hypertension. N Engl J Med 2013;369:319-29 (CHEST-1).
11- Simonneau G. et al. Riociguat For The Treatment Of Chronic Thromboembolic Pulmonary Hypertension (DTEPH): A phase III long term extension study (CHEST-2) 5th World Symposium of Pulmonary hypertension (WSPH) 2013; Nice, France. Poster Presentation
12- Rubin LJ, Galie N, Grimminger F, et al. Riociguat For The Treatment Of Pulmonary Arterial Hypertension (pah): A Phase Iii Long-Term Extension Study (patent-2). B98. CLINICAL TRIALS IN PULMONARY HYPERTENSION. May 1, 2013, A3531-A3531, American Thoracic Society 2013 International Conference, May 17-22, 2013 - Philadelphia Pennsylvania
13- Bonderman D, Ghio S, Felix SB., et al. Riociguat for Patients With Pulmonary Hypertension Caused by Systolic Left Ventricular Dysfunction: A Phase IIb Double-Blind, Randomized, Placebo-Controlled, Dose-Ranging Hemodynamic Study. Circulation. 2013;128:502-511





